Acumuladores de plomo – Tecnología de ácido-plomo
Durante más de un siglo, las baterías de ácido-plomo han sido las más utilizadas y las más exitosas comercialmente debido a que son un tipo de batería maduro, de bajo coste y de rápida disponibilidad. Los primeros antecedentes de baterías de ácido-plomo datan de 1800, año en el que Alessandro Volta descubrió la batería galvánica. En 1859 Gaston Planté desarrolló la primera batería de ácido-plomo gracias a su descubrimiento del incremento de la capacidad de almacenamiento de las celdas. Más tarde, en el año 1881, el científico Camille Faure mejoró algunas de las características que se habían aplicado anteriormente, como la sustancia que cubría la superficie de las placas, y fue a partir del trabajo de Faure que se aceleró el desarrollo de la batería de ácido plomo. La celeridad de este proceso fue debida al menor tiempo de fabricación de las placas de la batería y al desarrollo paralelo de las máquinas de generación de corriente eléctrica (que facilitaron enormemente la carga de las baterías).
Ya en el siglo XX, la batería de ácido-plomo era un producto de uso popularizado en múltiples aplicaciones que engloban desde la automoción y la tracción hasta usos en comunicaciones e iluminación.
Estructura y funcionamiento
Un acumulador de energía (también conocido como batería) es un conjunto de células individuales, o celdas, en las que tiene lugar una reacción química reversible. En el caso de la batería de ácido-plomo, ésta contiene diversas celdas de cuatro elementos básicos: dos electrodos (uno negativo y otro positivo), un separador y un electrolito. El conjunto que forman los electrodos, el electrolito y el separador se denomina celda, y el grupo de celdas es lo que conforma una batería o una pila. Las baterías de ácido-plomo funcionan a partir de una doble conversión de energía en un proceso electroquímico. La primera conversión se da en el proceso de carga y se transforma energía eléctrica en energía química, y en el proceso de descarga se produce la segunda conversión, en la que se transforma energía química en eléctrica.
Las células individuales de la batería constan de dos placas (electrodos) que se encuentran sumergidas en una sustancia (electrolito) que está compuesta por ácido sulfúrico (H₂SO₄) y agua destilada. Cuando las placas están cargadas, el electrodo positivo está relleno de óxido de plomo (PbO₂) y el negativo de plomo (Pb). Cuando se descarga la batería, se produce una reacción química en el electrolito que provoca que tanto el electrodo positivo (PbO₂) como el negativo (Pb) pasen a ser sulfato de plomo (PbSO₄), de manera que la energía química acumulada se transforma en energía eléctrica. En cuanto al electrolito, esta sustancia tiene como función principal permitir la migración de electrones entre electrodos, y el separador es una membrana porosa que permite el paso de electrones a través suyo mientras evita el contacto entre los electrodos.
Químicamente, estos procesos de carga y descarga de los electrodos podrían ser eternos si no fuese por el desprendimiento y sedimentación paulatina de los materiales de las placas durante los ciclos de vida. Estos materiales son elementos que cuando se desprenden dejan de formar parte de la reacción química y, por tanto, la capacidad de réplica de la carga se va reduciendo a medida que se cumplen ciclos de vida hasta que, ya cuando el sulfato de plomo forma cristales muy grandes, la batería deja de funcionar.
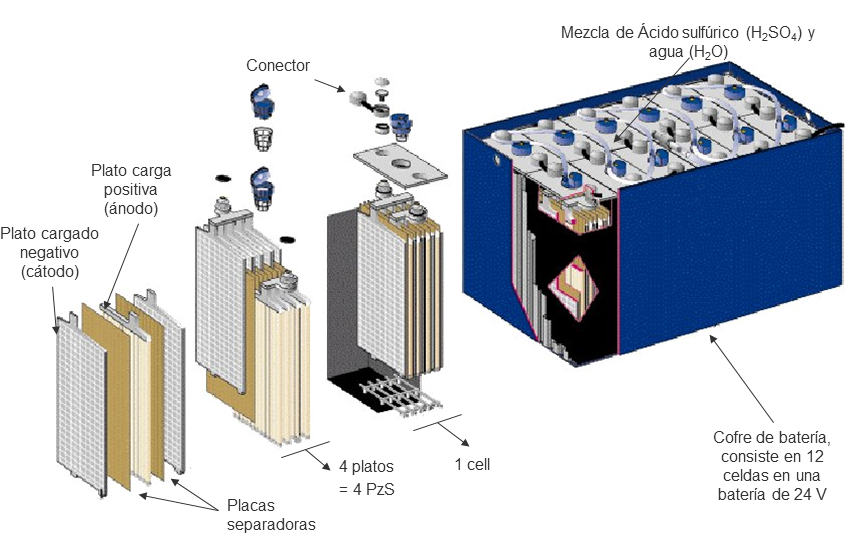
Gráfico 1. Esquema de una batería de ácido plomo. Fuente: Exide







